切刻内切酶—体外诊断新工具
2020年3月30日,时任美国总统特朗普和美国FDA局长哈恩在白宫草坪上举行记者招待会,现场推介雅培的ID NOW便携式核酸检测仪,号称其最快能够在5分钟内检测新冠病毒RNA。这款IVD史上最牛“直播带货”推介的快速诊断设备,使用的就是切刻酶扩增反应 (Nicking Enzyme Amplification Reaction, NEAR) 技术。

图1 特朗普为ID NOW“带货”
切刻内切酶 (nicking endonuclease) 是一类特殊的Type II限制酶,只切割DNA双链中特定的一条链(见《限制酶分类知多少(上)》),形成切刻缺口。利用切刻内切酶和等温扩增反应,研究者开发了一系列新型快速检测技术,为体外诊断提供了许多有力的新工具[1]。下面就让我们来了解一下近年来几项具有代表性的切刻酶等温扩增技术。
NEAR技术是在链置换扩增反应 (SDA) 技术基础上发展而来的一种快速等温扩增技术,又被称为切刻酶辅助扩增 (NEAA)或切刻酶介导扩增 (NEMA),最早由Ionian公司在2008年开发并形成专利[2],后辗转被雅培收购。NEAR技术主要使用耐热的切刻内切酶(如Nt.BstNBI、Nt.BspQI等)和具有链置换活性的DNA聚合酶(如Bst DNA聚合酶等)[3],通过一对特殊设计的带有切刻酶识别序列的引物,最快可以在5 min内实现109倍扩增。
NEAR技术核心原理见图2。
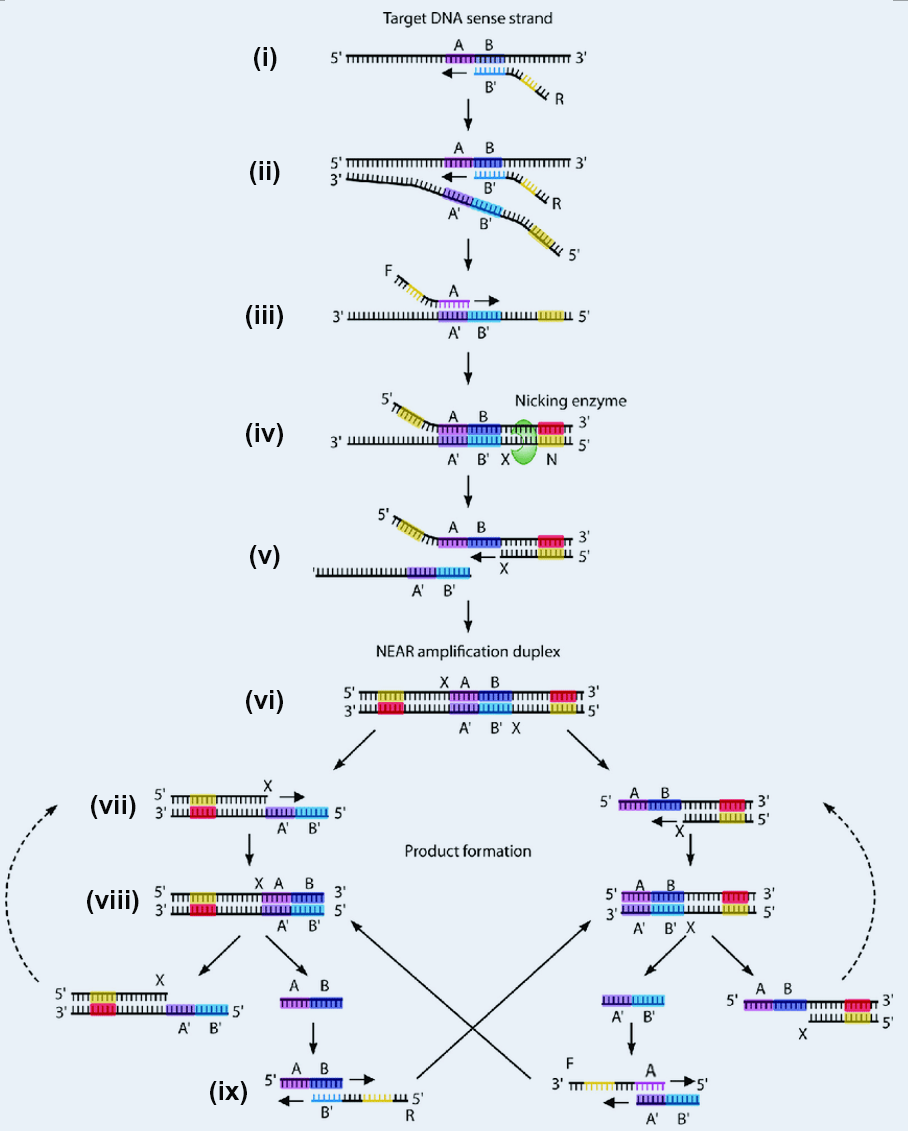
(i) 反向引物R的3'端B'区域与待测模板上互补的B区域退火配对,DNA聚合酶开始扩增延伸反向引物R。
(ii) 在DNA聚合酶的链置换活性作用下,第2条反向引物结合到第1条反向引物开始结合的位置,将第1次反向扩增的单链产物置换下来。
(iii) 正向引物F的3'端A区域与反向扩增产物上互补的A'区域退火配对,DNA聚合酶开始扩增延伸正向引物F。
(iv) 扩增产物下游含有完整的切刻酶识别位点N和酶切位点X,切刻酶切割单链形成切刻缺口。
(v) 反向扩增产物上酶切位点X下游的单链解离释放,DNA聚合酶从X开始扩增延伸。
(vi) 形成NEAR扩增双链,上下游各带有一个不同方向的切刻酶酶切位点X。
(vii) 切刻酶在上下游分别切割,形成两种切刻缺口;DNA聚合酶分别从两个缺口向各自下游扩增。
(viii) 生成两种只带有一个切刻酶酶切位点X的双链扩增产物;切刻酶分别在两种双链产物上切割,切刻缺口下游的单链解离,形成AB和A'B'两种单链探针。
(ix) 两种单链探针分别能与正反向引物中对应的互补区域结合,引发新一轮扩增,循环产生(viii) 中的双链扩增产物。
指数扩增反应 (EXPAR)
2021年,英国伯明翰大学研究者在《美国国家科学院院刊》(PNAS) 上发表论文,提出了一种不依赖逆转录的新冠病毒核酸检测技术,即无逆转录指数扩增反应 (RTF-EXPAR),能够在50-60℃恒温下,8分钟内检测出低至7.25拷贝/μl的新冠病毒RNA;而灵敏度和特异性与现有技术相当[6]。2022年,该技术被独家授权给Innova Medical Group, Inc.
这里用到的指数扩增反应 (Exponential Amplification Reaction, EXPAR) 最早出现于2003年[7],前面介绍的NEAR技术其实与它有异曲同工之妙。与NEAR不同,EXPAR技术利用单链触发探针 (Trigger) X和单链功能模板 (Functional template) X'-X'(X'与探针X互补,两段重复的X'之间由切刻酶的酶切位点连接),在切刻内切酶 (如Nt.BstNBI、Nt.BspQI等) 和具有链置换活性的DNA聚合酶(如Bst DNA聚合酶等)的共同作用下,能够在几分钟内实现106-109倍的扩增。
EXPAR技术核心原理见图3。

(i) 触发探针X与功能模板X'-X'上游的X'互补配对;
(ii) 在DNA聚合酶的作用下,以X为引物向下游扩增,形成X-X / X'-X'双链;
(iii) 切刻内切酶在X-X / X'-X'双链中间切割,形成切刻缺口;
(iv) 具有链置换活性的DNA聚合酶在切刻处,以上游X为引物进行链置换扩增,下游原有的X被置换脱落;
(v) 游离的触发探针X再与单链X'-X'结合,触发新一轮循环。
大家可能注意到,EXPAR的功能模板X'-X'比较特殊,要求两段完全相同的重复序列X'之间还要有切刻酶的识别位点,这种序列很难在天然的DNA或RNA中找到。因此实际的EXPAR反应中一般不加入触发探针X,而只加入人工合成的功能模板X'-X',以及一段用于启动最初几轮反应的起始单链探针[8]。
EXPAR检测基因组DNA的常用起始策略如图4所示。

(i) 基因组DNA变性后,与能和基因组互补配对的起始探针X'-Y'(Y'与X'序列不同,之间仍由切刻内切酶识别位点连接)退火;切刻内切酶切割形成切刻缺口。
(ii) 具有链置换活性的DNA聚合酶在切刻缺口处以X'为模板开始扩增,原基因组DNA切口下游的单链被置换解离。
(iii) 切刻内切酶切割扩增产物形成切刻缺口。
(iv) 具有链置换活性的DNA聚合酶再在缺口处以X'为模板进行链置换扩增,本次被置换下来的单链DNA即为触发探针X。
(v) 触发探针X与预先加入的功能模板X'-X'互补配对,开始后续的EXPAR循环。
伯明翰大学开发的RTF-EXPAR技术,检测RNA时用了另一种起始策略,除了用到切刻内切酶,还需要另一种Type IIP限制酶,但不需要逆转录反应。
基本原理如图5所示。
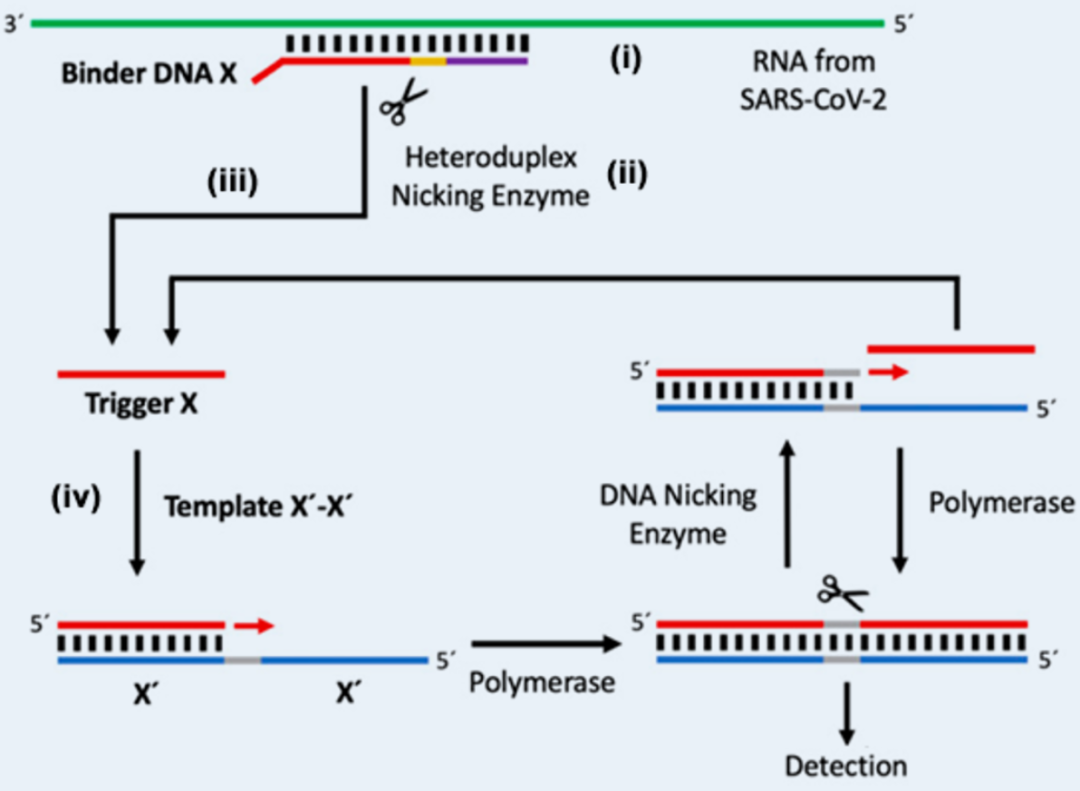
(i) 单链DNA粘结探针 (binder DNA) 的3'部分与RNA退火。粘结探针包括触发探针X(只有3'部分与RNA互补)、限制酶识别位点和另外一小段与RNA模板互补的片段,Tm高于反应温度。
(ii) 限制酶识别DNA-RNA杂合双链,但只切割DNA链。
(iii) 在等温扩增反应温度下(接近X与RNA配对部分的Tm),X与RNA解链脱离,成为触发探针。
(iv)触发探针X与预先加入的功能模板X'-X'互补配对,开始后续的EXPAR循环。
EXPAR技术具有反应快、灵敏度高、探针设计灵活、可检测短片段等优势,可以通过荧光染料、荧光基团、电化学或纳米颗粒等各种方式产生信号,已经被尝试用于检测核酸(DNA、mRNA、miRNA等)、蛋白质、酶活和金属离子等[8],还可以与CRISPR/Cas技术结合进一步提高灵敏度和特异性[9]。但EXPAR技术也存在探针设计难度大、非特异扩增较严重等缺点,目前已有一些生物信息学方法来辅助EXPAR探针设计[10],也有研究者探索了一些降低EXPAR非特异性扩增的策略。
结语
除上面介绍的NEAR和EXPAR技术之外,切刻酶相关的等温扩增技术还有链置换扩增 (SDA)、滚环扩增 (RCA) 等,本文限于篇幅不再展开。这些技术以快速、高灵敏度等优点,被用于体外诊断和科学研究等多个领域,以及合成生物学领域中构建DNA动态调控网络[11],未来发展空间巨大。
相关产品

参考文献:
1. Cao et al. (2022) Int J Mol Sci. 23:4620
2. Maples et al. (2009) U.S. Patent US20090017453A1
3. Qian et al. (2019) Anal Chim Acta. 1050:1-15
4. Safiabadi et al. (2021) Clin Microbiol Rev. 34:e00228-20
5. Nie et al. (2014) J Clin Microbiol. 52:3339–3344
6. Carter et al. (2021) PNAS. 118:e2100347118
7. Ness et al. (2003) PNAS. 100:4504-4509
8. Reid et al. (2018) Angew Chem Int Ed. 57:11856-11866
9. Niu et al (2023) Anal Chim Acta. 1251:340998
10. Qian et al. (2012) Nucleic Acids Res. 40:e87
11. Zhang et al. (2019) J Am Chem Soc. 141:17189–17197